

ゲノム編集技術の現状
基礎技術開発に立脚したゲノム編集研究
ゲノム編集は、まだ一般社会に広く認知されているとまでは言えないものの、ある程度科学に通じていれば、一度は耳にしたことがあるはずだ、と言っても過言ではない状況にあるかもしれない。では、現状でゲノム編集は一般にどう認知されているだろう。我々科学者にとって、ゲノム編集とは、本来プロセスを表す用語であり、「予め定義した配列を有する特定のゲノムDNA領域を切断し、編集する技術」を指す。しかし一般には、この機構を認識しているかどうかにかかわらず、結果として「遺伝子を改変して性質を変化させた生物や細胞」がイメージされるのではないだろうか。腐りにくいトマト、筋肉量が増加したタイ、そして遺伝性疾患を修復した再生医療用細胞――いずれも「ゲノム編集によってできるもの」ではあるが、「ゲノム編集技術そのもの」ではない。
今でこそゲノム編集は、出来合いのツールや簡単な自作キットが多くの試薬メーカーから売り出され、分子生物学の基礎知識があれば誰でも扱えるほど身近な技術となっているが、筆者がゲノム編集の技術開発に取り組み始めた2010年頃には、まだまだ専門家でなければ扱い切れない代物であった。まずは目的のDNA領域を切断するタンパク質を発現させるためのベクターを作らなければ始まらない、ということで、当該のベクターを簡便に作製し、その性能を迅速に評価するためのシステムを開発した。その後、既存のDNA切断酵素では必ずしもその活性が十分でないことを問題視し、タンパク質の構造を最適化することでDNA切断の活性を上昇させた改良型酵素を開発した。更に、標的DNAを切断した後に切断面が修復される機構に着目し、外来のDNAが効率的に取り込まれる新手法を開発した。このように、筆者の研究開発は常にゲノム編集の基盤的プロセスに介入したものであり、それが本当の意味でのゲノム編集研究ではないかと筆者は考えている。
前述のように、ゲノム編集は、農水畜産物の品種改良や遺伝子治療などへの応用が可能であり、一般社会に大きな影響を与え得る技術であるため、その安全性や倫理基準をどのように評価・決定していくかが喫緊の課題となっている。一方で、プロダクトだけを見ていては、技術そのものの本質を捉えることはできない。ゲノム編集を施した生物や細胞について、「何が起こっているかわからないから危険だ」というイメージをもたれることが往々にしてあるが、ゲノム編集の技術基盤を理解せずしてその安全性を計ることは不可能である。ゲノム編集の応用が急速に進んでいる状況であるからこそ、基礎技術開発に携わる人間と、応用を進める産学の研究者、規制当局、生命倫理学者、そして一般市民がそれぞれの理解を深め、対話を進めていく必要があるだろう。
(担当:教育実習委員会 佐久間)
モデル生物におけるゲノム編集技術
大腸菌(原核生物)、酵母(真核生物)、ショウジョウバエ(昆虫)、ニワトリ(鳥類)、マウス(哺乳類)などの多様な生物種が普遍的な生命現象を調べるためのモデル生物として利用されてきた。ゲノム編集技術は、全ての生物に共通する遺伝情報の担い手であるDNAに対して人為的に二重鎖切断を引き起こす技術であるので、広範囲な生物種において自在にゲノム改変を行うことが可能となってきている。これまで、多くのモデル脊椎動物(メダカ、ゼブラフィッシュ、カエル、イモリなど)では胚性幹細胞(embryonic stem cell: ES cell)が樹立できておらず、マウスで威力を発揮している胚性幹細胞を基盤とした標的遺伝子の破壊法(ノックアウト)が確立されていなかった。このような状況は、近年のCRISPR/Cas9法の開発により一変しており、標的遺伝子に対するsgRNAとCas9 mRNAをモデル脊椎動物由来の受精卵に注入するだけで、高頻度で標的ゲノム部位に挿入・欠失変異を誘導することが可能となっており、その結果、比較的簡便に遺伝子機能欠損変異体(ノックアウト)を作成することができるようになってきている。さらに、ゲノム編集時に外来遺伝子(ドナーベクター)を一緒に注入することで、標的ゲノム部位に自在に外来遺伝子を挿入できる技術(ノックイン)が開発されてきている。これまで、マウスの独壇場であったゲノム改変技術は、多くのモデル脊椎動物においてCRISPR/Cas9法による最適化が進んでおり、それぞれの生物種の特性を活かした生命科学研究を展開できる段階にきている。
図1 ゼブラフィッシュを例に、ノックアウトとノックインを紹介する。メラニン合成に寄与するチロシネースに対するsgRNAとCas9タンパク質をゼブラフィッシュ受精卵に注入した場合(図1B)、高頻度で網膜上皮細胞(矢頭)の色素合成に異常を示す胚が観察された(図1Aは、未処理のコントロール胚を示す)。チロシネース遺伝子の標的部位に様々な挿入・欠失変異が導入されることで、分子機能が破壊されたと考えられた(ノックアウト)。
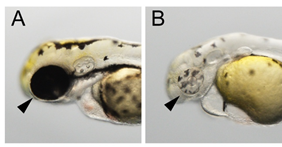
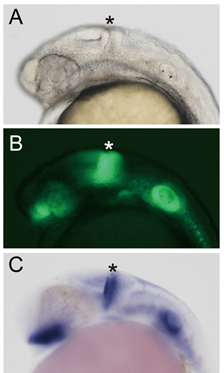
図2 ホメオボックス型転写因子pax2a遺伝子は、眼柄、中脳後脳境界部(図2C, 星印)、耳胞に特異的な発現が認められる。pax2a遺伝子の開始コドン近傍に、hsp70プロモーター領域をGFP(緑色蛍光タンパク質)遺伝子に接続したレポーター遺伝子を挿入することにより、pax2a遺伝子の発現領域にGFPが特異的に発現されることが観察された(ノックイン)。
(担当:教育実習委員会 川原)
